Visitas: 0
– Es posible que algún día los virus que infectan bacterias reemplacen a los antibióticos porque atacan precisamente a patógenos específicos. Los investigadores de ETH Zurich ahora están demostrando que este no es siempre el caso. Este nuevo hallazgo es importante porque los virus bacterianos pueden transferir genes de resistencia a los antibióticos.
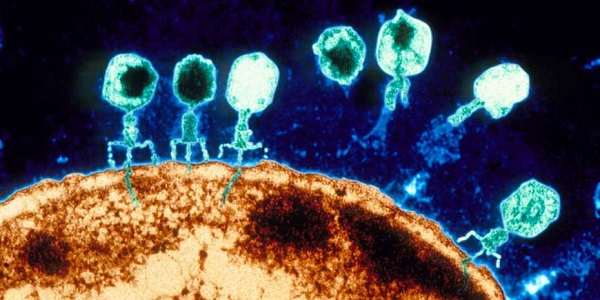
Cortesía de ETH por Rahel Kunzler: Los bacteriófagos (fagos para abreviar) son virus que solo infectan bacterias. Para capturar un huésped bacteriano, primero se unen a moléculas específicas en su superficie celular. Luego inyectan su material genético en la célula bacteriana. Para reprogramar la maquinaria celular de la bacteria para producir nuevas partículas virales, los fagos también necesitan ser más astutos que el sistema inmunológico de la bacteria objetivo.
Los puntos de entrada moleculares y el sistema inmunitario difieren de una bacteria a otra, por lo que se creía comúnmente que la mayoría de los fagos tienen un rango de hospedadores estrecho, es decir, solo infectan una sola especie bacteriana o incluso una subespecie. Esto también fue lo que condujo a la idea de usar asesinos de bacterias naturales para tratar infecciones, particularmente cuando las bacterias que causan enfermedades han adquirido resistencia a los antibióticos.
Ahora, sin embargo, un estudio dirigido por Elena Gómez-Sanz, investigadora asociada en el grupo de Martin Loessner, profesor de microbiología alimentaria en ETH Zurich, desafía la teoría del huésped fago de rango estrecho. Los fagos dentro del grupo de bacterias Staphylococcus generalmente infectan varias especies simultáneamente. Los investigadores publicaron recientemente sus resultados en la revista Nature Communications.
“Si queremos evaluar el papel de los fagos como vectores de la resistencia a los antibióticos, debemos observar el panorama completo, no solo la situación en la medicina humana”. Elena Gómez-Sanz, científica sénior
Sus hallazgos podrían tener consecuencias directas para la terapia con fagos, que aún no ha sido aprobada para su uso en Suiza, pero se ha utilizado durante mucho tiempo en Europa del Este. Los fagos no solo matan las bacterias, sino que también pueden transferir genes de resistencia a los antibióticos de una bacteria a otra. Por lo tanto, su gama inesperadamente amplia de presas significa que los fagos pueden propagar sus genes de resistencia mucho más en el medio ambiente de lo que se pensaba anteriormente.
Muchos nuevos fagos aislados en aguas residuales
Ya se conoce el mecanismo por el cual los fagos pueden transferir la resistencia a los antibióticos entre bacterias. En resumen, cuando estos virus se multiplican en las células bacterianas, no solo inyectan su propio material genético en nuevas partículas virales; en algunos casos, introducen de contrabando material genético de las bacterias infectadas (un gen de resistencia, por ejemplo) en las partículas del virus. Si una de estas partículas de virus infecta a una nueva bacteria, se puede transferir la resistencia.
En los estafilococos, esta forma de transferencia de genes ha sido particularmente bien estudiada. Este grupo de bacterias, que comprende más de 50 especies, coloniza naturalmente no solo a los humanos sino también al ganado, y se encuentra en cuerpos de agua naturales. El miembro más conocido de este grupo es el Staphylococcus aureus, una especie bacteriana que coloniza naturalmente nuestra nariz y piel, pero que recientemente se ha convertido en un peligroso patógeno multirresistente.
Se cree ampliamente que los fagos jugaron un papel crucial en la evolución del patógeno multirresistente más común y extendido de la actualidad. Por lo tanto, no sorprende que más del 90% de los fagos conocidos en Staphylococcus se originen a partir de Staphylococcus aureus, generalmente aislado de muestras clínicas.
“Sin embargo, si queremos evaluar el papel de los fagos como vectores de resistencia a los antibióticos, tenemos que mirar el panorama completo, no solo la situación en medicina humana”, dice Gómez-Sanz.
En busca de la gama más amplia posible de fagos de Staphylococcus naturales, los investigadores de ETH visitaron las plantas de tratamiento de aguas residuales. Después de todo, aquí converge una gran diversidad de bacterias y sus fagos: de la microbiota humana, del ganado, de los hogares y la industria. Los investigadores aislaron un total de 94 fagos de las aguas residuales para su estudio.
Los virus abarcan una red gigante para la transferencia de genes
Los investigadores realizaron experimentos de laboratorio para identificar el patrón de presa natural de sus fagos aislados. Para hacer esto, dejaron caer los fagos en diferentes bacterias huéspedes potenciales y estudiaron sus patrones de infección. Las 117 cepas bacterianas estudiadas en total incluyeron representantes de 29 especies diferentes de Staphylococcus y bacterias de diferentes hábitats, con y sin resistencia a los antibióticos.
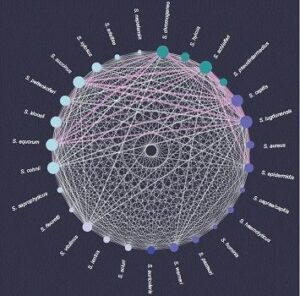
Descubrieron que un fago infecta, en promedio, cuatro especies bacterianas diferentes. O, desde el punto de vista de la bacteria, los fagos “compartidos” pueden permitir que una especie de estafilococo intercambie material genético con, en promedio, más de otras 17 especies. “Esta enorme red muestra el tremendo impacto que los fagos pueden tener en las comunidades bacterianas”, dice Gómez-Sanz.
La hipótesis del rango estrecho de huéspedes probablemente ha sobrevivido durante tanto tiempo porque casi no hay estudios similares previos que investiguen la infectividad de los fagos en muchas especies bacterianas diferentes, dice el microbiólogo. El trabajo anterior a menudo se limitaba estrictamente a especies bacterianas clínicamente relevantes como S. aureus. Sin embargo, el presente estudio muestra la necesidad urgente de investigar particularmente la prevalencia de la resistencia a los antibióticos más allá del alcance de las biosferas individuales.
“La salud humana está íntimamente ligada a la salud de los animales y del medio ambiente”, dice Gómez-Sanz. El estudio destaca la importancia del moderno “enfoque One Health” en el uso de antibióticos. Los nuevos hallazgos en la red de fagos naturales individuales muestran, por ejemplo, que los fagos pueden transferir la resistencia a los antibióticos de las bacterias en la microbiota animal directamente a los patógenos humanos. Esto subraya la importancia del moderno “enfoque de una sola salud” para el uso de antibióticos.
Todavía no está claro con qué frecuencia se propagan los genes de resistencia
Es difícil estimar a partir de los experimentos de laboratorio realizados hasta la fecha con qué frecuencia los fagos realmente transfieren genes de resistencia a los antibióticos en la naturaleza. Sin embargo, el estudio actual hace una suposición acerca de cuáles de los fagos investigados son vectores particularmente potentes.
Para 28 de los 94 fagos, los investigadores de ETH investigaron con qué frecuencia pueden detectar un gen de resistencia natural mientras propagan los fagos en una bacteria desde la red generada. La frecuencia de absorción varió de 1 en 100 partículas a 1 en 10 millones.
Estas enormes diferencias se deben a los distintos ciclos de vida y enzimas que utilizan los virus para empaquetar su material genético. “Algunos son ‘más propensos a errores’ que otros, lo que significa que tienden a incluir algún material genético bacteriano en el paquete”, explica Gómez-Sanz. Si, además, este tipo de fagos tiene una amplia gama de huéspedes, el riesgo de transferencia es aún mayor.
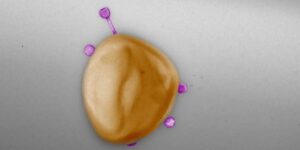
Como enfatizan los autores, los resultados del estudio también son significativos con respecto a la lucha contra las bacterias patógenas en humanos usando fagos. El descubrimiento de que los fagos pueden tener una amplia gama de huéspedes debe considerarse positivo. Esto hace que sea más fácil usarlos contra innumerables bacterias diferentes.
Sin embargo, cuando se utilizan fagos en medicina, se debe tener cuidado de que no actúen adicionalmente como vectores de genes de resistencia a los antibióticos. Por lo tanto, es importante asegurarse de que los fagos utilizados en medicina tengan un mecanismo de propagación que funcione lo más perfectamente posible.
Este trabajo fue apoyado por el programa nacional de investigación “Resistencia a los Antimicrobianos” NRP 72
Referencia: Göller PC, Elsener T, Lorgé D, Radulovic N, Bernardi V, Naumann A, Amri N, Khatchatourova E, Coutinho F, Loessner MJ, Gómez-Sanz E: Gama de hospedadores multiespecies de fagos estafilocócicos aislados de aguas residuales. Comunicaciones de la naturaleza 12: 6965, 2021. doi: 10.1038/s41467-021-27037-6
Articulo relacionado: Bacterias-Nueva idea de antibiótico evitará que las bacterias se peguen
Dejar una contestacion